Estudio avanzado en el varón
Técnica de análisis citogenético en Clínica Mencía
Servicios de ginecología en Salamanca y servicios de ginecología en Plasencia: Reproducción asistida
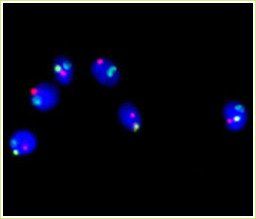
FISH DE ESPERMATOZOIDES
La Hibridación in situ fluorescente (FISH) de espermatozoides es una técnica de análisis citogenético que consiste en marcar con sondas de ADN fluorescente cromosomas específicos en el núcleo de los espermatozoides en estadío de interfase, para poder determinar si presentan o no un dotación cromosómica correcta. Esta técnica nos permite evaluar el riesgo de transmisión de anomalías cromosómicas de origen paterno a la descendencia, en muestras obtenidas tanto de eyaculado como de epidídimo y testículo.
En la actualidad se esta introduciendo el FISH de espermatozoides como una prueba diagnostica más en el estudio de infertilidad del varón, en nuestro centro se solicita en los siguientes casos: Pacientes con cariotipo normal:
- Parámetros espermáticos anormales: oligozoospermia y teratozoospermia grave.
- Azoospermia obstructiva o secretora.
- Estudio de meiosis anormal en biopsia de testículo.
- Pacientes sometidos a un tratamiento de quimioterapia o radioterapia.
- Aborto de repetición de causa desconocida.
- Fallo repetido de implantación tras técnicas de reproducción asistida.
- Embarazo previo con una cromosopatía.
En todos estos casos se analizarían los cromosomas 13, 18, 21, X e Y. Se añadiría demás en el último caso el cromosoma implicado en la anomalía previa.
Pacientes con cariotipo anormal:
- Portadores de alteraciones cromosómicas estructurales: translocación recíproca y robertsoniana.
En estos casos se analizan los cromosomas implicados en la alteración. - Portadores de alteraciones cromosómicas sexuales: síndrome de Klinefelter (XXY) y varones XYY:
En estos casos se estudian los cromosomas 13, 18, 21, X e Y.
Se estudian estos cromosomas porque son los que normalmente se encuentran alterados en mayor proporción, sin embargo existe la posibilidad de estudiar otros cromosomas como son el 15,16, 17 y 22, obteniendo de esta manera un estudio más completo.
Alteraciones tras el estudio de FISH de espermatozoides
Los resultados obtenidos tras el estudio de FISH de espermatozoides se comparan con los valores de referencia de muestras obtenidas de una población control de donantes fértiles normozoospérmicos.
A nivel clínico, consideramos que un resultado de FISH es anormal cuando se observa un incremento significativo de anomalías para los cromosomas analizados al compararlos con los de la población control. En estos casos, las alternativas que se puedes ofrecer a la pareja son:
- Diagnóstico prenatal en caso de embarazo.
- Diagnóstico genético preimplantacional: si la incidencia de anomalías cromosomicas es muy elevada.
- Semen de donante: si se encuentran anomalías en la mayoría o en todos los cromosomas analizados, lo que sería indicativo de una alteración grave de la meiosis.
FRAGMENTACIÓN DE ADN EN ESPERMATOZOIDES
La fragmentación del ADN espermático es un parámetro adicional de medida de calidad seminal. Si la fragmentación del ADN es mayor del 30% se produce un efecto negativo sobre el éxito del ciclo. La medida de la fragmentación del ADN confiere a los clínicos una herramienta adicional para tomar decisiones en la práctica diaria.
¿Cuándo se recomienda evaluar la fragmentación de ADN?
- Para la de decisión de la técnica de reproducción a aplicar (IUI, IVF o ICSI).
- Para la evaluación rutinaria de la calidad seminal de paciente y donantes.
- Para la evaluación de la eficacia de las intervenciones médicas y del tratamiento de enfermedades infecciosas.
- Para buscar la posible causa de infertilidad idiopática, fallos repetidos del ciclo u abortos de repetición.
¿Qué decisiones clínicas pueden tomarse en base al índice de fragmentación de ADN (DFI)?
1) Parejas que pueden someterse a IUI
Valores altos de DFI (Índice de fragmentación de ADN) reduce el éxito del ciclo de IUI, de 16% a 4% o menos. Sin embargo, los mismos valores de DFI no influyen en el éxito de los ciclos de IVF o ICSI, siendo más exitosos los ciclos de ICSI. Aunque la fragmentación de ADN tiene un impacto negativo en los ciclos de IVF e ICSI, el efecto queda enmascarado por la selección los espermatozoides antes de la fecundación.
2) Para evaluar la calidad seminal de paciente o donantes
La comunidad internacional ha expresado la necesidad de revisar los criterios de evaluación de calidad seminal utilizados en la actualidad para mejorarlos. En base a las técnicas disponibles actualmente, la medida de la fragmentación de ADN puede mejorar la evaluación tradicional para obtener una información más precisa.
3) Para evaluar la eficacia de las intervenciones médicas o el tratamiento de enfermedades infecciosas
a) Varicocele
La medida de DFI después de una varicocelectomía provee un parámetro más cuantificable que la morfología para evaluar la eficacia de la intervención. La medida de DFI permite al clínico seguir la evoluación del paciente y seleccionar las mejores muestras seminales a lo largo del tiempo.
b) Chlamydia trichomatis y Micoplasma
El porcentaje de espermatozoides con fragmentación de ADN es significativamente mayor cuando hay infección de Chlamydia trichomatis y Mycoplasma. La terapia antibiótica en estos pacientes demostró una disminución de los niveles de DFI.
4) Encontrar explicación a los casos de infertilidad idiopática, fallo de ciclo y abortos de repetición
Altos niveles de DFI influyen en la tasa de fecundación y la calidad embrionaria, conduciendo a un mayor índice de abortos de repetición y menores tasas de éxito de los ciclos. Los fallos se deben a una baja calidad de ADN del espermatozoide.
Cuando el valor de DFI es mayor al 30%, el clínico debe considerar la presencia de factores que producen una mayor fragmentación del ADN, como puede ser: medicación, compuestos tóxicos, fiebre, tabaco, drogas, enfermedades infecciosas, varicocele, edad y abstinencia prolongada. Se ha demostrado una disminución del DFI mediante el tratamiento con 1g de vitamina C y 1 g de vitamina E administrada diariamente durante 2 meses o Menevit (antioxidante)‐ una cápsula diaria durante 3 meses antes del ciclo.







